CTD – eCTD vom Spezialisten
Mit dem internationalen Standard für Einreichungen von Arzneimittelzulassungen, dem CTD (Common Technical Document), wurde im Rahmen der International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH) ein Datenformat zur Harmonisierung der Arzneimittelzulassungsbedingungen in der Europäischen Union, den USA und Japan eingeführt. Durch die Harmonisierung ist es möglich, in verschiedenen Ländern für ein neues Arzneimittel weitgehend identische Zulassungsunterlagen einzureichen.
Die behördlichen Anforderungen an die zur Zulassung eines Arzneimittels erforderlichen klinischen und präklinischen Studien sind aufgrund der ständigen Fortschritte und neuen Erkenntnisse stetig gestiegen. Dies gilt auch für die Anforderungen an die Qualität der Arzneimittel. In der Folge stieg das notwendige Datenvolumen und die Komplexität der Zulassungsdossiers, wodurch die Bearbeitung und Begutachtung in Papierform sich zunehmend erschwerte.
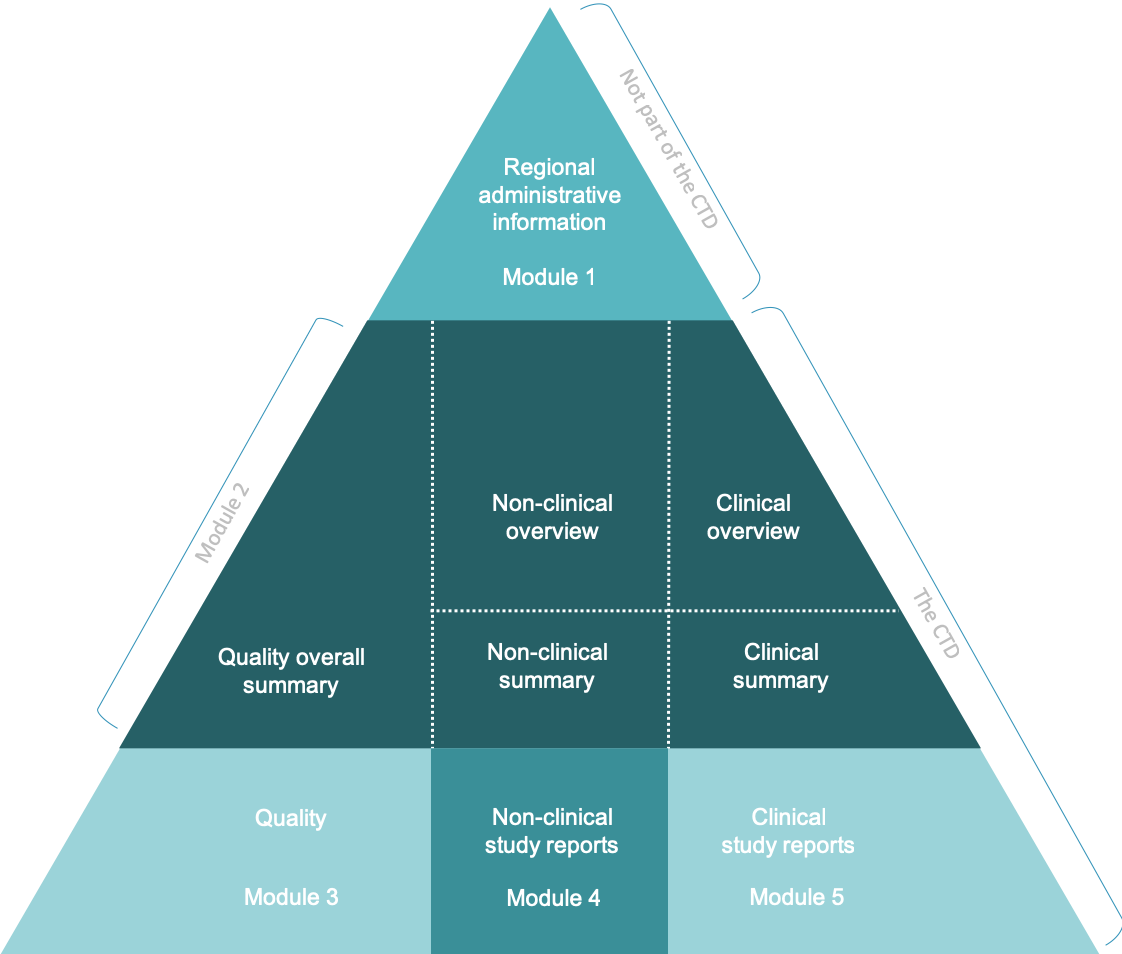
Um diese Datenmengen für Antragsteller und Behörden besser handhabbar zu machen, wurde ein elektronisches Format, das eCTD (electronic Common Technical Document), definiert. Inhaltlich basiert das eCTD auf dem CTD (Common Technical Document)-Format, das aus 5 Modulen besteht.
CTD – eCTD richtig gemacht
Erstellen - Konvertieren - Kompilieren - Validieren - Pflegen
orangeglobal übernimmt für Sie die eCTD Erstellung und Pflege (lifecycle management) bereits bestehender Arzneimitteldossiers. Darüberhinaus bieten wir die Erstellung oder Umformatierung ihrer Dossiers aus Vorgängerformaten ins CTD Format.
Unser Prozess für die Erstellung von Zulassungsdossiers, die die Eingangsvalidierung bei den zuständigen Behörden problemlos passieren, enthält:
- Erfassung Ihres Aufkommens an Zulassungsanträgen
- Analyse der bestehenden Dossiers (Papier-oder elektronische Dossiers, NTA-Format und älter, außereuropäische Formate, NeeS und eCTD)
- Erarbeitung von Vorschlägen zur technischen Lösung (Neuerstellung, Aktualisierung/Pflege, Umformatierung)
- Aufbau eines Projektteams und Bestimmung der Rollen und Verantwortlichkeiten
- Erstellung des Dossiers mit den Modulen 1 bis 5 (z.B. EU-CTD):
- Modul 1: Anträge, Unterlagen, Produktinformationen, Lesbarkeitstests etc.
- Modul 2: Zusammenfassungen und Übersichten der Module 3, 4 und 5
- Modul 3: Qualität und Herstellung – chemische, pharmazeutische und biologische Arzneimittel
- Modul 4: Präklinische Dokumentation
- Modul 5: Klinische Dokumentation
- Übersetzung aller oder nur ausgewählter Dossierkapitel durch unser Übersetzungs- und Sprachmanagement in allen gewünschten Zielsprachen
- Umformatierung bereits bestehender Dossiers in die aktuellen Formate., z.B. eCTD, NeeS oder Papierdossiers usw. unter Berücksichtigung aller Behördenanforderungen und Validierungskriterien
- Behördenkommunikation währende des gesamten Prozesses
Gerne senden wir Ihnen ein detailliertes Angebot basierend auf den zur Verfügung gestellten Dossierinformationen Ihrer Arzneimittel und Ihren Zielen.
Bitte, nehmen Sie Kontakt auf mit:
Frau Dipl. Biol. Jana Wolkow
Project Manager Regulatory Affairs
Tel. +49 (0) 731 954 95 - 511
jana.wolkow@orangeglobal.(.)de